Exercícios de Aplicação:
1- Verifica se as equações químicas seguintes, satisfazem ou não à Lei de Lavoisier (mesmo número de atómos nos reagentes e nos produtos da reação)
Em caso negativo, procede ao seu acerto.
a) Fe + O2 → Fe3O4
b) HgO → Hg + O2
c) S8 + O2 → SO2
d) SO2 + O → SO3
e) P4 + O2 → P2 + O5
f) NH3 + NO → N2 + H2O
2- Escreve as equações químicas que traduzem as reacções químicas descritas a
seguir e se necessário procede ao seu acerto.
a) O ácido clorídrico (HCl) reage com o magnésio (Mg), formando-se cloreto de
magnésio (MgCl2) e libertando hidrogénio.
b) O óxido de sódio (Na2O) reage com a água, transformando-se em hidróxido de
sódio (NaOH).
c) O carbono ( C) reage com o oxigénio, formando-se dióxido de carbono.
Soluções:
1-
a) Fe3 + 2O2 → Fe3O4
b) 2HgO → 2Hg + O2
c) S8 + 8O2 → 8SO2
d) SO2 + O → SO3
e) P4 + 5O2 → 2P2 + 2O5
f) 4NH3 + 6NO → 5N2 + 6H2O
2-
a) HCI + Mg → MgCl2 + H
b) Na2O + H2O → NaOH
c) C + O → CO2
sábado, 8 de dezembro de 2012
Lei de Lavoisier
O número de átomos de cada elemento químico nos reagentes é igual ao número de átomos nos produtos de reação.
"Na Natureza nada se perde nada se cria, tudo se transforma"
"Na Natureza nada se perde nada se cria, tudo se transforma"
Símbolos Químicos
- 1ª letra é sempre maiúscula
- 2ª letra é sempreminúscula
- A leitura é feita letra a letra
H---» Hidogénio
O---» Oxigénio
C---» Carbono
Ca---» Cálcio
N---» Azoto
Cu---» Cobre
Fe---» Ferro
Imformação qualitativa- informa o nome do elemento químico
Informação quantitativa- informa o número de átomos desse elemento químico (H- 1 átomo de hidrogénio; 2H- 2 átomos de hidrogénio)
Átomos, Moléculas e Iões
Toda a matéria é constituida por particulas extremamente pequenas chamadas corpúsculos. Há varios tipos de corpúsculos:
- Átomos
- Moléculas
- Iões
Átomos
O átomo é constituido por:
- Protão: Carga elétrica postiva (encontra-se no núcleo)
- Neutrão: Sem carga elétrica (encontra-se no núcleo)
- Eletrão: Carga elétrica negativa (encontra-se na nuvem eletrónica)
- (Nº protões = Nº eletrões)
Moléculas
As moléculas são conjuntos de átomos ligados entre si.
Há 2 tipos de moléculas:
- Molécula elementar- é constituída por átomos do mesmo elemento químico (CO2 --» 1 átomo de C e dois de O)
- Molécula composta- é constituída por átomos de diferentes elementos químicos (N--» 1 átomo de N)
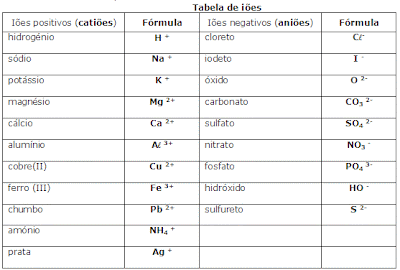
Iões
Reações de precipitação
As reações de precipitação caracterizam-se pela formação de um precipitado (sólido) obtido a partir dos reagentes que se encontram dissolvidos
Solubilidade- Quantidade máxima de soluto que é possivel dissolver num litro de solvente, a uma dad temperatura
Estalactites e estalagmites
O dióxido de carbono existente no ar dissolve-se na água da chuva e origina uma solução ligeiramente ácida. Assim, quando a água da chuva se infiltra através da gruta, reage com o carbonato de cálcio, originando hidrogenocarbonato de cálcio, que fica dissolvido na água.
Dióxido de carbono (g) + Água (l) --» Hidrogenocarbonato de Cálcio (aq)
Á medida que a solução aquosa de hidrogenocarbonato de cálcio vai escorrendo através da gruta, a água vai-se evaporando e, então, parte do hidrogenocarbonato transforma-se novamente em carbonato de cálcio.
Hidrogenocarboanto de cálcio (aq) --» Dióxido de carbono (g) + Água (g) + Carbonato de cálcio (s)
O carbonato de cálcio é pouco solúvel em água e, por isso, volta a precipitar.
Solubilidade- Quantidade máxima de soluto que é possivel dissolver num litro de solvente, a uma dad temperatura
Estalactites e estalagmites
O dióxido de carbono existente no ar dissolve-se na água da chuva e origina uma solução ligeiramente ácida. Assim, quando a água da chuva se infiltra através da gruta, reage com o carbonato de cálcio, originando hidrogenocarbonato de cálcio, que fica dissolvido na água.
Dióxido de carbono (g) + Água (l) --» Hidrogenocarbonato de Cálcio (aq)
Á medida que a solução aquosa de hidrogenocarbonato de cálcio vai escorrendo através da gruta, a água vai-se evaporando e, então, parte do hidrogenocarbonato transforma-se novamente em carbonato de cálcio.
Hidrogenocarboanto de cálcio (aq) --» Dióxido de carbono (g) + Água (g) + Carbonato de cálcio (s)
O carbonato de cálcio é pouco solúvel em água e, por isso, volta a precipitar.
O que é o pH?
A maior ou menor acidez ou basicidade depende da concentração da solução e da força do ácido ou da base respectiva e é medida pela escala de pH (a letra p é sempre minúscula e a letra H é sempre maiuscula). A escala de pH é uma escala numérica que varia entre 0 e 14. Assim, a escala de pH permite avaliar a maior ou menor acidez ou basicidade de uma solução.
Uma solução ácida tem pH inferfior a 7. Este valor é tanto mais baixo quanto mais acentuado for o carácter ácido da solução.
Uma solução neutra tem pH igual a 7.
Uma solução básica tem pH superior a 7. Este valor é tanto mais alto quanta mais acentuado for o carácter básico da solução.
Uma solução ácida tem pH inferfior a 7. Este valor é tanto mais baixo quanto mais acentuado for o carácter ácido da solução.
Uma solução neutra tem pH igual a 7.
Uma solução básica tem pH superior a 7. Este valor é tanto mais alto quanta mais acentuado for o carácter básico da solução.
Reações Ácido-Base
Características das soluções ácidas:
Indicadores:
Os indicadores são substâncias naturais ou sintéticas cuja cor na presença de uma solução é alterada. Os indicadores mais utilizados são o azul de tornesol e a fenolftaleína.
- Têm sabor azedo
- Reagem com os metais, produzindo hidrogénio
- Conduzem a electricidade
- Alteram a cor de certos corantes vegetais
Características das soluções básicas:
- Têm saber amargo
- São escorregadias ao tacto
- Conduzem a electricidade
- Alteram a cor de certos corantes vegetais
As soluções que nao são ácidas nem básicas são soluções neutras.
Os indicadores são substâncias naturais ou sintéticas cuja cor na presença de uma solução é alterada. Os indicadores mais utilizados são o azul de tornesol e a fenolftaleína.
- Soluções ácidas: Tornam o azul de tornesol vermelho. A fenolftaleína não sofre alterações de cor na presença de uma solução ácida.
- Soluções Neutras: Tornam o azul de tornesol azul-arroxeada. A fenolftaleína não sofre alterações de cor na presença de uma solução neutra.
- Soluções Básicas: O azul de tornesol não sofre alterações de cor na presença de uma solução básica. Tornam a fenolftaleína carmim
terça-feira, 4 de dezembro de 2012
Combustão
O que é uma combustão?
É uma reacção química exotérmica entre uma substância (o combustível) e um gás (o comburente), geralmente o oxigénio, para libertar luz e calor.Durante a combustão são formados diversos produtos resultantes da combinação dos átomos dos reagentes. Para ocorrer a reacção de combustão é necessário uma fonte de ignição.
Que nome se dão aos reagentes de uma combustão?
Aos reagentes dá-se o nome de combustível e comburente. O comburente é o oxigénio e o combustível é o material que arde.
Que produtos se formam numa combustão?
Forma-se luz e calor.
O que é a combustão lenta?
É a combustão que não é acompanhada por chama
Respiração celular: açúcar (s) + oxigénio (g) ---» dióxido de carbono (g) + água (g) + energia
É uma reacção química exotérmica entre uma substância (o combustível) e um gás (o comburente), geralmente o oxigénio, para libertar luz e calor.Durante a combustão são formados diversos produtos resultantes da combinação dos átomos dos reagentes. Para ocorrer a reacção de combustão é necessário uma fonte de ignição.
Que nome se dão aos reagentes de uma combustão?
Aos reagentes dá-se o nome de combustível e comburente. O comburente é o oxigénio e o combustível é o material que arde.
Que produtos se formam numa combustão?
Forma-se luz e calor.
O que é a combustão lenta?
É a combustão que não é acompanhada por chama
Respiração celular: açúcar (s) + oxigénio (g) ---» dióxido de carbono (g) + água (g) + energia
Reacção do sódio com a água
Sódio + Água ---» Hidróxido de sódio + Hidrogénio
Transformações Físicas e Químicas
Transformações Físicas- são aquelas que ocorrem sem que se formem novas substâncias, as substâncias continuam a ser as mesmas, poderão apenas estar mais divididas, mudarem de estado físico ou mudarem de posição.
Exemplos de transformações físicas:
Exemplos de transformações físicas:
- Um papel que se rasga
- Um vidro que se parte
- A água que se evapora
- Um gelado que derrete
Transformações Químicas- são aquelas em que se formam novas substâncias, isto é, substâncias com propriedades diferentes das substâncias iniciais.
Exemplos de transformações químicas:


Nas transformações químicas as substâncias inicias chamam-se reagentes e as substâncias finais chamam-se produtos de reação
Exemplos de transformações químicas:

- Quando grelhas um bife
- Um fósforo que arde
- A fotossíntese realizada pelas plantas
- O enferrujamento do ferro
Maneiras de detectar as transformações químicas:
- Mudança de cor
- Mudança de cheiro
- A formação de um sólido
- A formação de uma chama
- A libertação de um gás

Nas transformações químicas as substâncias inicias chamam-se reagentes e as substâncias finais chamam-se produtos de reação
Subscrever:
Mensagens (Atom)